Glykoproteine
 Medizinische Expertise: Dr. med. Nonnenmacher
Medizinische Expertise: Dr. med. NonnenmacherQualitätssicherung: Dipl.-Biol. Elke Löbel, Dr. rer nat. Frank Meyer
Letzte Aktualisierung am: 9. März 2024Dieser Artikel wurde unter Maßgabe medizinischer Fachliteratur und wissenschaftlicher Quellen geprüft.
Sie sind hier: Startseite Laborwerte Glykoproteine
Etwa die Hälfte aller Proteine im menschlichen Körper sind Glykoproteine. Die Substanzen spielen sowohl als Zellbestandteile, als auch Immunsubstanzen eine Rolle. Sie werden vorwiegend im Rahmen der sogenannten N-Glykosylierung gebildet und können bei fehlerhaftem Zusammenbau schwerwiegende Krankheiten hervorrufen.
Inhaltsverzeichnis |
Was sind Glykoproteine?
© marina_ua – stock.adobe.com
Glykoproteine sind Proteine mit baumartig verzweigten Heteroglykanresten. Sie sind meist von viskoser Konsistenz. Die Makromoleküle enthalten kovalent gebundene Zuckergruppen.
Sie bestehen aus Monosacchariden, wie Glucose, Fructose, Mannose oder acetyliertem Aminozucker. Deshalb werden sie auch als proteingebundene Oligosaccharide bezeichnet. Die kovalente Bindung kann auf unterschiedlichen Wegen erfolgen und entspricht entweder einer Bindung an die Aminosäuren Serin oder Asparagin. Die Bindung an Serin wird O- und die an Asparagin N-Glykosylierung genannt. Die Glykoproteine der N-Glykosylierung variieren in der Größe. Sie entsprechen Monosacchariden, Di- oder Oligosacchariden bis hin zu Polysacchariden.
Nach ihrem Anteil an Monosacchariden werden sie in mannosereiche, komplexe und hybride Glykoproteine unterschieden. In der mannosereichen Gruppe überwiegen Mannose-Reste. In der komplexen Gruppe überwiegen Saccharide. Die hybride Gruppe ist eine Mischform. Der Kohlenhydratanteil von Glykoproteinen liegt zwischen wenigen Prozent bei Ribonukleasen und bis zu 85 Prozent bei den Blutgruppenantigenen.
Funktion, Wirkung & Aufgaben
Zur Zellinteraktion tragen sie als Membranproteine bei. Einige Glykoproteine erfüllen auch hormonelle Funktion, wie der Wachstumsfaktor hCG. Ebenso wichtig sind die Substanzen als immunologische Bestandteile in Form von Immunglobulinen und Interferonen. Sämtliche Exportproteine und Membranproteine des Körpers waren zumindest bei der Biosynthese noch Glykoproteine. Für die Erkennungsreaktionen im Immunsystem sind sie besonders relevant, da sie mit immunologischen T-Zellen und T-Zell-Rezeptoren in Interkation treten. Im menschlichen Blutplasma wurden verschiedene Plasmaproteine isoliert, von denen lediglich Albumin und Präalbumin keine Zuckerreste aufweisen.
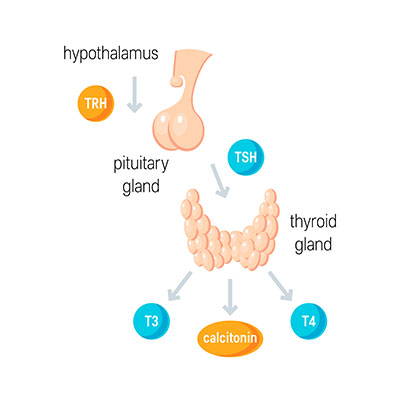
Die Häufigkeit von Glykoproteinen ist erstaunlich. Letztlich weisen fast alle extrazellulär löslichen Proteine und Enzyme Reste von Zucker auf. Als Hormone haben Glykoproteine pleiotrope Wirkung und sind so für die Aktivität verschiedener Organsysteme entscheidend. Die Hormone TSH, HCG und FSH sind zum Beispiel Glykoproteine. Als Membranprotiene sind sie sowohl in der Rolle des Rezeptors, als auch in der des Transporteuers und des Stabilisators vertreten. Stabilisierend wirken sie vor allem gemeinsam mit Glykolipiden. Sie bilden zusammen mit diesen Stoffen die sogenannte Glykokalyx, die zellwandlose Zellen stabilisiert.
Bildung, Vorkommen, Eigenschaften & optimale Werte
Die verbreitetste Bildungsform von Glykoproteinen ist die N-glykosidische Bindung oder N-Glykosylierung an Asparagin. Zucker bindet sich dabei an den Stickstoff freier Säureamidgruppen. Die N-Glykosylierung findet im endoplasmatischen Retikulum statt. Die so gebildeten N-Glykoside sind die relevanteste Glykoproteingruppe.
Bei der N-Glykosylierung snythetisiert die Zucker-Vorstufe in Unabhängigkeit von der Aminosäuresequenz des Zielproteins am Trägermolekül Dolichol. Die OH-Gruppe am Ende des Moleküls ist mit Diphosphat verknüpft. Am terminalen Phosphatrest der Moleküle wird eine Oligosaccharid-Vorstufe gebildet. Die ersten sieben der Zucker bauen sich auf der cytosolischen Seite zusammen. Zwei N-Acetyl-Glucosamine und fünf Manose-Reste werden an das Dolichol-Phosphat angebaut. Die Zucker-Nukleotide GDP-Mannose und UDP-N-Acetyl-Glucosamin treten als Donoren in Erscheinung. Die Vorstufe wird über ein Transportprotein durch die ER-Membran transportiert.
Damit ist die Vorstufe zur Innenseite des endoplasmatischen Retikulums orientiert, wo ihr vier Mannose-Reste hinzugefügt werden. Zusätzlich werden Glucose-Reste angebaut. Die 14 Zucker lange Vorstufe wird schließlich auf ein Protein übertragen. Ein anderer Bildungsweg für Glykoproteine ist die O-glykosidische Bindung oder O-Glykosylierung an Serin, die im Golgi-Apparat der Zellen vorgenommen wird. Die Bindung des Zuckers findet dabei an eine Hydroxygruppe des Serin statt. Werte für Glykoproteine sind vor allem im Bezug auf die Plasmaprotein relevant, wie sie bei einem großen Blutbild eine Rolle spielen. An dieser Stelle alle Normwerte für Glykoproteine einzeln aufzulisten, würde den Rahmen sprengen.
Krankheiten & Störungen
Schielen kann ein weiteres Symptom für die genetische Erkrankung sein. Insgesamt sind rund 250 verschiedene Gene an der Bildung von Glokoproteinen beteiligt. Bei angeborenen Glykosylierungsstörungen liegen aufgrund einer genetischen Disposition Störungen in der Anheftung von Kohlenhydratseitenketten an Proteine vor. In der posttranslationellen Modifizierung erhalten Proteine ihre volle Funktionsfähigkeit. Wenn bei diesem Prozess Enzyme oder Proteine abnormal zusammengebaut werden, die Kohlenhydratseitenketten aufbauen, dann entsteht CDG. Die N-Glykosylierung ist am häufigsten von Störungen betroffen. Bislang wurden rund 30 Enzymdefekte entdeckt, die Auswirkungen auf die N-Glykosylierung haben.
Genetische O-Glykosylierungsstörungen sind etwas seltener. Sie äußern sich in neuromuskulären Multisystemerkrankungen, wie dem Walker-Warburg-Syndrom. Da Glykoproteine derart viele Funktionen im Organismus übernehmen, ist das Krankheitsbild von vielfältigen Symptomen geprägt. Alle Organsysteme können von angeborenen Glykosylierungsstörungen betroffen sein. Psychomotorische Entwicklungsstörungen sind das Leitsymptom. Ebenso oft zeigen sich neurologische Auffälligkeiten. Auch Gerinnungsstörungen oder endokrine Störungen sind keine Seltenheit.
Quellen
- Classen, M., Diehl, V., Kochsiek, K. (Hrsg.): Innere Medizin. Urban & Fischer, München 2009
- Neumeister, B. et al.: Klinikleitfaden Labordiagnostik. Elsevier/Urban & Fischer, München 2009
- Reuter, P., Hägele, J.: Aminosäuren Kompendium. Ein Leitfaden für die klinische Praxis. Hyginus Publisher GmbH, Bad Homburg 2001
